Dear temen-temen….dapat kasus baru neh….dari adik adik angkatan…
dia bertanya apa fungsi dari aquades pada percobaan kinetika reaksi ion permanganat dan asam oksalat?? Jika tidak mengetahui cara kerjanya, maka pastinya kita juga bingung….
jadi percobaan itu mungkin seperti ini :
Isi erlermeyer dengan larutan H2C4O4 dan larutan KMnO4 reaksikan dengan :
Erlenmeyer 1 : 10 ml H2CO4, 2 ml KMnO4,4 ml H2O
Erlenmeyer 2 : 20 ml H2CO4, 2 ml KMnO4,7 ml H2O
Erlenmeyer 3 : 10 ml H2CO4, 4 ml KMnO4,10 ml H2O
nah…rasa penasarannya dia mungkin muncul??emang air kok volumenya beda – beda kenapa???
nah ini jawabannya….
Kecepatan reaksi pada temperature tetap , ternyata berbanding lurus dengan konsentrasi dan masing – masing berpangkat sesuai banyaknya jumlah molekul dalam persamaan reaksi .Nah…artinya, bahwa apabila konsentrasi jumlahnya tinggi, maka reaksi akan semakin cepat. Lantas hubungan dengan penambahan aquadest apa??
gini nih…klo H2CO4 dan KMnO4 itu dicampur maka yang bergesekan dan bereaksi kemungkinan hanyalah sisi – sisi partikel yang bergesekan..sehingga molekul – molekul tidak akan bertemu secara langsung semuanya dan tidak akan bereaksi.
di balik, apabila 1 molekul H2CO4 dan KMnO4 ditempatkan dalam 1 bak air kolam renang, maka dia akan susah bertemunya sehingga tidak akan terjadi reaksi, (ini mah juga sama dengan mencari jodoh yang tepat, semakin kita mempunyai banyak kegiatan yang membuka wawasan, mah kita akan semakin tau, dimana reaksi yang itu jodohkita, mungkin, hehehe)…Ilmiahnya adalah dapat dilustrasikan dengan gambar dibawah ini :
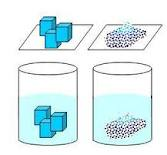 tidak akan bereaksi jika hanya di tempatkan saja, kemudian jika ukuran partikel terlalu besar, gesekan hanya sedikit. ukuran partikel gesekan untuk jadi reaksi banyak,dan yang lebih banyak potensi apabila dalam bentuk molekul. salah satu jalan membuat bentuk molekul adalah dengan melarutkannya dalam pelarut yang tidak bereaksi, itu air untuk kasus ini.
tidak akan bereaksi jika hanya di tempatkan saja, kemudian jika ukuran partikel terlalu besar, gesekan hanya sedikit. ukuran partikel gesekan untuk jadi reaksi banyak,dan yang lebih banyak potensi apabila dalam bentuk molekul. salah satu jalan membuat bentuk molekul adalah dengan melarutkannya dalam pelarut yang tidak bereaksi, itu air untuk kasus ini.
 nah…jika molekul dalam air, semakin banyak, maka akan semakin mudah terjadi tumbukan sehingga semakin cepat reaksi. Ini dalam kasus praktikum ini ditandai dengan perubahan warna (iya g de???). dan semkin encer, maka tumbukan akan semakin sulit terjadi…gitu tuh jawabannya…!!!
nah…jika molekul dalam air, semakin banyak, maka akan semakin mudah terjadi tumbukan sehingga semakin cepat reaksi. Ini dalam kasus praktikum ini ditandai dengan perubahan warna (iya g de???). dan semkin encer, maka tumbukan akan semakin sulit terjadi…gitu tuh jawabannya…!!!
gitu…..de!!!nah faktor –faktor lain yang mempengaruhi terjadinya laju reaksiantara lain :
- Sifat Pereaksi
Salah satu factor penentu laju reaksi adalah sifat pereaksinya, ada yang reaktif dan ada juga yang kurang reaktif. Misalnya saja bensin lebih cepat terbakar daripada minyak tanah. Demikian juga logam Natrium bereaksi cepat dengan air. Sedangkan logam magnesium lambat.
- Suhu
Hamper semua reaksi menjadi lebih cepat apabila terjadi peningkatan suhu, karena kalor yang diberikan akan menambah energy kinetic partikel pereaksi. Akibatnya jumlah dan energy tabrakan bertambah besar.
- Katalis
Laju suatu reaksi dapat ( umumnya dipercepat) dengan menambahkan zat yang disebut Katalis. Katalis sangat diperlukan dalam reaksi zat organic, termasuk dalam organism. Katalis dalam organism disebut enzim yang dapat mempercepat proses terjadinya reaksi di dalam tubuh
sumber http://rega42.wordpress.com/2011/04/26/kinetika-reaksi-ion-permanganat-dengan-asam-oksalat/
Leave a Reply